(通讯员 吴丹雅)近日,我院苗义良教授团队与清华大学颉伟教授团队合作在MolecularCell上发表了题为“Analysis of genome architecture during SCNTreveals a role of cohesin in impeding minor ZGA”的研究论文,揭示了核移植胚胎发育过程中染色质三维结构的动态重编程过程以及结构蛋白cohesin参与抑制胚胎基因组激活(ZGA)的作用。
动物体细胞核移植(即动物克隆)是指将体细胞的核移入去核卵母细胞中,使其发生重编程并发育为新的胚胎,这个胚胎最终能发育为动物个体。这是唯一一种能将终端分化的体细胞转变成为具有全能性胚胎的技术,然而该技术存在效率低、克隆动物出生率低等问题。近年来在分子水平上对克隆胚胎发育过程中存在的重编程障碍作了大量研究,并建立了多种方法来提高克隆胚胎发育率。随着染色体构象捕获技术与高通量测序技术(Hi-C)等三维基因组学技术的快速发展,这些技术揭示了许多重要生物学事件中的染色质三维结构的动态变化过程。在小鼠早期胚胎发育过程中,研究人员利用优化的微量细胞全基因组染色质构象捕获技术(sisHi-C)发现了染色质三维结构随着胚胎发育的进行而逐步建立巩固,然而对于小鼠核移植早期胚胎发育过程中的染色质三维结构的动态变化却了解甚少。
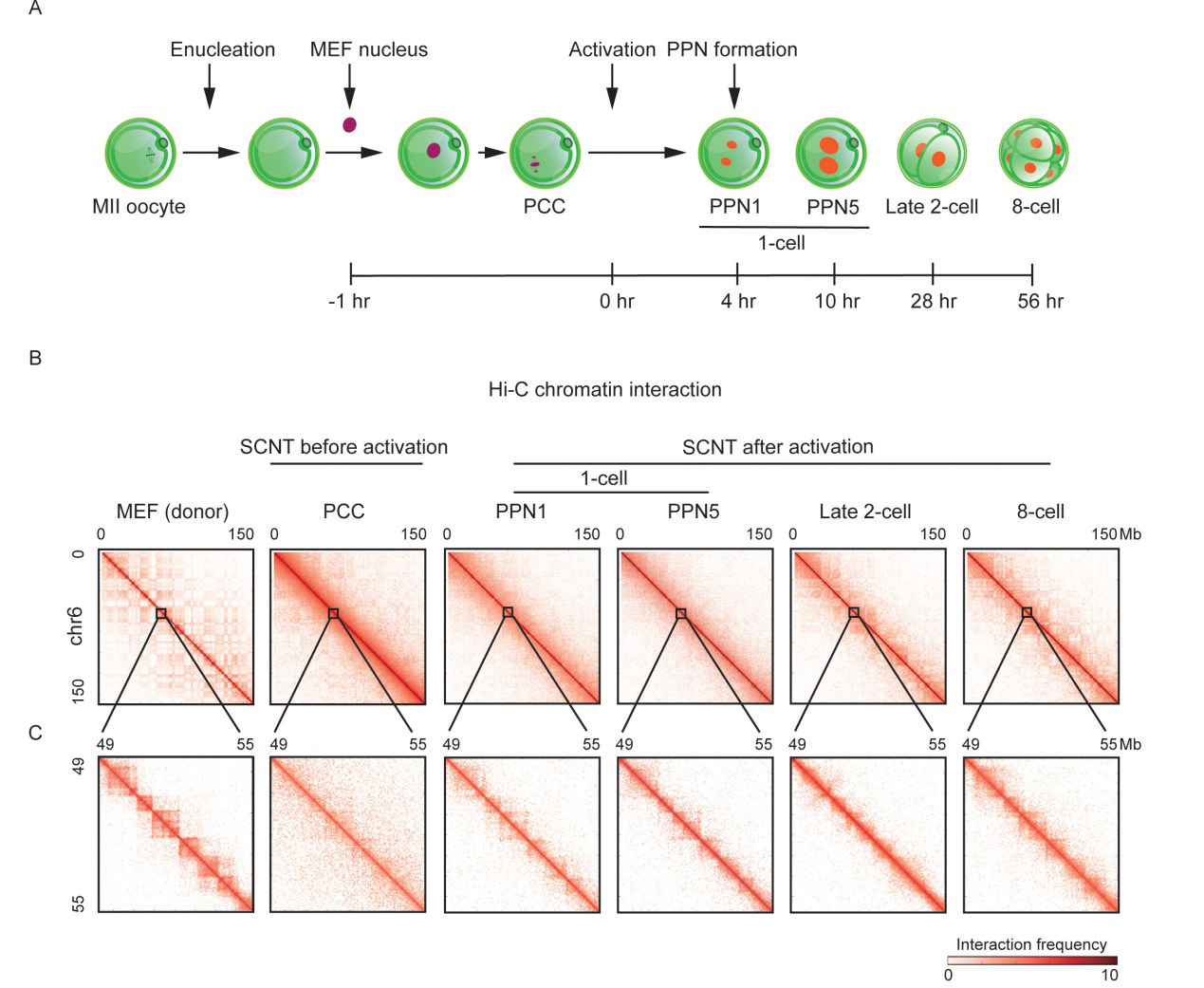
体细胞核移植早期胚胎的染色质三维结构图
在本研究中,通过对核移植胚胎采样并进行sisHi-C测序,绘制了小鼠核移植早期胚胎发育过程中的染色质三维结构动态变化图谱。结果显示:在体细胞被注入去核卵母细胞后,体细胞的染色质三维结构被消解并出现了类中期样结构。这是由于卵胞质中存在大量的促成熟因子促使体细胞核出现染色体凝集现象。此外,与受精胚胎相比,克隆胚胎在激活后原核时期的TAD结构要强于受精胚胎,并且在二细胞时期TAD结构减弱。团队人员猜测原核时期的强TAD结构可能是阻碍核移植胚胎发育的原因之一。针对这一猜测,将体细胞的结构蛋白(cohesin)利用植物激素诱导降解系统(AID)进行短暂预敲除,发现其TAD结构显著减弱。随后将cohesin预敲除后的体细胞进行核移植发现可以显著提高克隆囊胚率。通过对这些胚胎的进一步组学分析发现,尽管cohesion预敲除后克隆原核时期胚胎的TAD结构无显著变化,但克隆二细胞时期的minorZGA基因表达却显著上调。此外,还发现cohesin预敲除后的体细胞的minorZGA的表达及对应的H3K27ac修饰都显著上调。这些现象表明了cohesin预敲除后使得体细胞染色质变得更松散从而促进了核移植早期胚胎的染色质结构重编程。上述结果对于研究体细胞重编程机制和提高动物克隆效率及应用具有重要的意义。
我院博士研究生吴丹雅和清华大学张珂、王瑶和郑辉为论文共同第一作者,苗义良教授和清华大学颉伟教授为论文通讯作者。本研究受到了国家重点研发计划和国家自然科学基金的资助。
论文链接:https://doi.org/10.1016/j.molcel.2020.06.001